Ths.Lê Đức Hải – Giám Đốc R&D Công Ty Cổ Phần UV
GÓC NHÌN TỪ NGHIÊN CỨU VÀ ỨNG DỤNG THỰC TIỄN
UV-GLUCANRON.S1 - Sự kết hợp của Intereron heo PoIFN-α và PoIFN-γ tái tổ hợp biểu hiện từ tế bào Pichia pastoris: Liệu pháp đi từ nguyên lý đến thực tế phòng trị bệnh ASF và PRRS
Đặt vấn đề
Cùng với sự tăng trưởng không ngừng của ngành chăn nuôi heo ở nước ta, tình hình dịch bệnh cũng diễn biến phức tạp ảnh hưởng lớn đến tính ổn định của đàn, năng suất và hiệu quả chăn nuôi. Trong đó, bệnh Dịch tả heo Châu Phi (ASF) và Hội chứng rối loạn hô hấp và sinh sản (PRRS được xem như là hai thách thức lớn nhất ở thời điểm hiện tại. Hai bệnh này có đặc điểm dịch tễ phức tạp, tính đa dạng về di truyền, sự phổ biến, tỷ lệ bệnh/chết cao, khả năng gây suy giảm miễn dịch cấp tính và gây ảnh hưởng lớn đến năng suất chăn nuôi heo (Đỗ Tiến Duy và Đỗ Thị Ngọc Trâm, 2025).
Để kiểm soát bệnh tổng thể, mô hình an toàn sinh học (ATSH) mới được xem là một chiến lược quan trọng, với cấu trúc trại cần được phân định ra thành 03 vùng an toàn sinh học khác nhau về mặt không gian, được đặt tên là vùng Nguy cơ - Vùng Đệm - Vùng Sạch. 3 vùng này ngăn cách nhau bởi các lớp hàng rào an toàn sinh học, hàng rào an toàn sinh học ngăn cách các vùng không chỉ là tường rào (phần cứng) mà còn là quy trình hoạt động của trại (phần mềm), được tái sắp xếp theo một trật tự mới. Tất cả yếu tố nguy cơ vào trại được giới hạn, quản lý, kiểm soát và kiểm dịch ở vùng nguy cơ đầu tiên. Vùng đệm thêm một lớp tiếp tục được kiểm dịch chặt chẽ và có ý nghĩa về không gian và thời gian đảm bảo giảm thiểu tối đa nguy cơ nhằm bảo vệ vùng an toàn tốt nhất (Đỗ Tiến Duy và Đỗ Thị Ngọc Trâm, 2025).
Bên cạnh việc áp dụng nguyên lý của phòng bệnh truyền nhiễm với việc cắt đứt 1 trong 3 khâu của vòng truyền lây bệnh: nguồn bệnh (mầm bệnh), thú cảm thụ (vật chủ) và môi trường là vấn để cốt lõi để kiểm soát bệnh hiệu quả. Thực tế các mầm bệnh truyền nhiễm quan trọng trên heo có tính phức tạp nên cần chọn lựa và áp dụng phối hợp các biện pháp một cách linh hoạt mới đem lại hiệu quả; trong đó,
- Loại trừ mầm bệnh: biện pháp loại đàn/tái đàn và xét nghiệm/loại heo
- Môi trường nuôi an toàn không có mầm bệnh: biện pháp di chuyển tách biệt heo đến nơi khác, cai sữa sớm/tách biệt và đóng đàn
- Biện pháp tạo miễn dịch chủ động hay bị động: tiêm phòng chủ động, phơi nhiễm tự nhiên hoặc dùng thuốc, các chế phẩm tác động vào vật chủ để. Trong đó, việc ứng dụng chế phẩm có tính năng sinh học như interferon (IFN type I và II), có tiềm năng mang lại hiệu quả tốt trong các trường hợp kiểm soát nhiễm trùng virus, hỗ trợ điều trị và tăng cường hiệu quả của tiêm phòng bệnh (Đỗ Tiến Duy và Đỗ Thị Ngọc Trâm, 2025)
Cơ chế tác động Interferon alpha (IFN-α) và Interferon gamma (IFN- γ)
Interferons (IFNs) là các cytokine kháng virus đóng vai trò then chốt trong phản ứng miễn dịch bẩm sinh đối với các bệnh nhiễm virus. Cơ thể sau khi phát hiện tác nhân gây bệnh và sản xuất IFN, IFN liên kết với các thụ thể của chúng và khởi động một chuỗi tín hiệu, dẫn đến sự điều hòa phiên mã chính xác của hàng trăm gen được IFN kích thích (IFN - stimulated genes ISG). Điều này dẫn đến trạng thái kháng virus đáng kể ở vật chủ, có hiệu quả chống lại virus RNA và DNA (Schoenborn và Wilson, 2007; Gonzalez-Navajas và cộng sự, 2012).
Là thành viên chính của họ IFN, IFN-α và IFN- γ đóng vai trò quan trọng trong miễn dịch bẩm sinh chống lại nhiều bệnh nhiễm trùng do vi-rút khác nhau (Sainz và Halford, 2002; Garcia-Sastre và Biron, 2006; Liu và cộng sự, 2013).
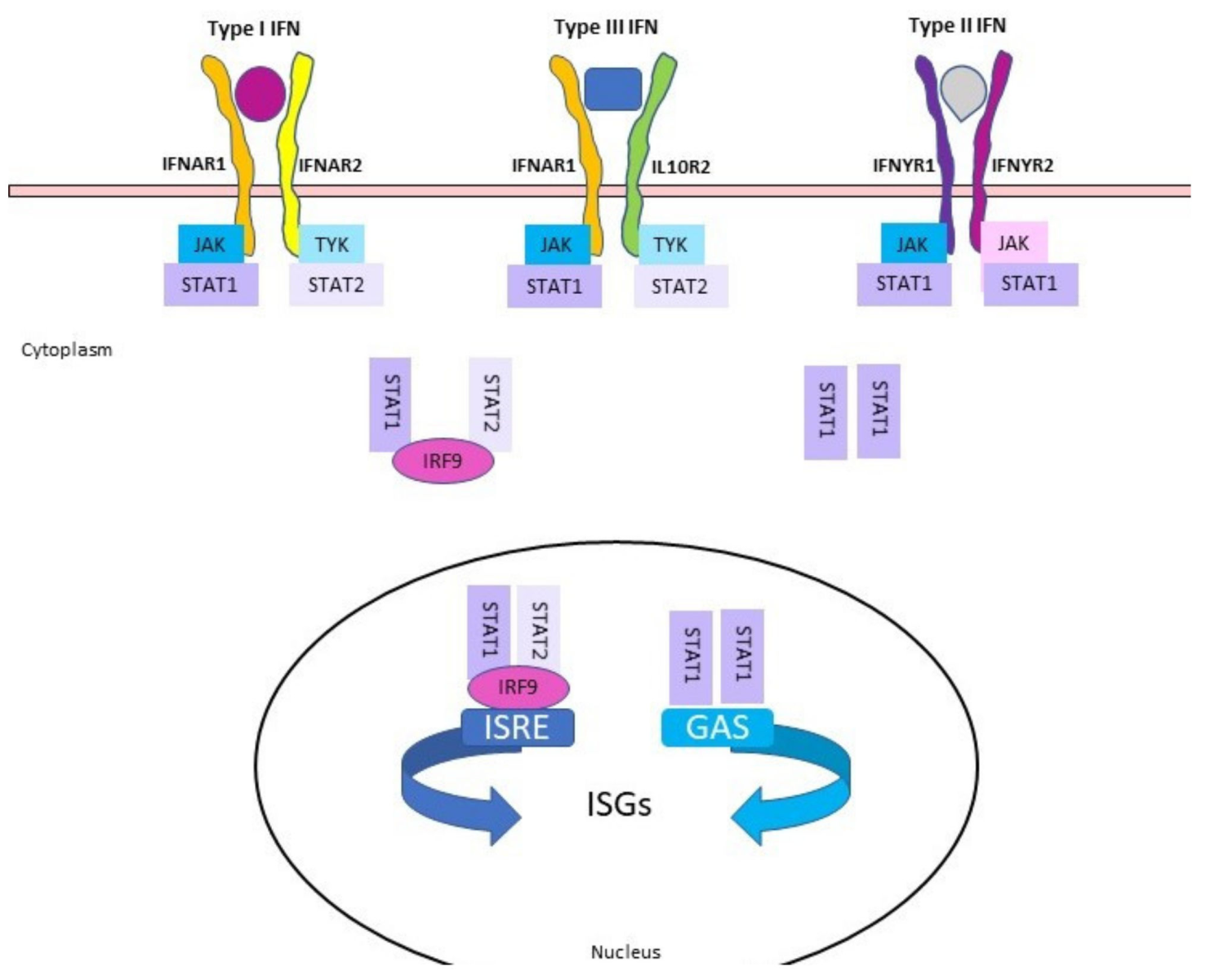
Hình 1. Sơ đồ các chuỗi truyền tín hiệu của IFN. Mỗi loại IFN đều có một thụ thể bề mặt tế bào. IFN loại I liên kết với IFNAR (gồm IFNAR1 và IFNAR2); IFN loại III liên kết với IFNLR (gồm IFNAR1 và IL-10R2) và IFN loại II liên kết với IFNYR (gồm IFNYR1 và IFNYR2). Sự liên kết của IFN với thụ thể của chúng gây ra sự phosphoryl hóa của JAK và TYK trên vùng tế bào chất của thụ thể. Điều này dẫn đến sự phosphoryl hóa STAT1 và STAT2
IFN-α được tiết ra bởi hầu hết các tế bào trong hầu hết các bệnh nhiễm trùng do vi-rút (Samuel, 1998) và thông qua liên kết với thụ thể dị hợp tử của nó (IFNAR1 và IFNAR2), nó kích hoạt sự biểu hiện của nhiều ISG thông qua hoạt hóa con đường JAK-STAT (Sadler và Williams, 2008; Schneider và cộng sự, 2014). IFN- α tác động như một hormon, nhờ cAMP tác động vào nhân tế bào cảm ứng bộ gene tế bào tổng hợp các enzyme kinase, 2,5-oligoadenylat synthetase, 2,5-phosphodiesterase, protein Mx, β2 microglobulin. Các protein này tham gia ức chế ở những giai đoạn khác nhau trong chu kì sao chép của virus. Enzyme kinase (PKR), được hoạt hoá bởi RNA sợi đôi (double strand RNA), sẽ phosphoryl hoá và làm bất hoạt eIF-2 (yếu tố khởi đầu dịch mã của virus), do đó, ức chế tổng hợp protein. Enzyme 2,5-oligoadenylat synthetase (OASE), cũng được hoạt hoá bởi RNA sợi đôi, sẽ xúc tác phân cắt ATP tạo oligoadenylat (2,5A), tiếp đến hoạt hoá enzyme ribonuclease nội bào (RNAse) phá huỷ mRNA của virus và do đó cũng ức chế luôn quá trình tổng hợp protein của virus. Hiệu quả khác trong chống virus của IFN-α là thông qua sự điều hoà miễn dịch (immunoregulation): tăng biểu hiện MHC, hoạt hoá đại thực bào, cung cấp nhiều tế bào NK và tế bào lympho Tc (T cytotoxic) và cảm ứng các cytokine (Tompkin, 1999). Hơn nữa, trong đáp ứng kháng virus, IFNs không chỉ thể hiện ở tế bào không bị nhiễm virus (paracrine) mà còn cảm ứng quá trình chết tế bào theo lập trình (apoptosis-programmed cell death) trên tế bào bị nhiễm (autocrine) (Tanaka et al., 1998). Ngoài ra, IFNs còn gây biến đổi màng tế bào để hạn chế sự phóng thích của virus cũng như màng tế bào chưa bị nhiễm nhằm hạn chế sự xâm nhiễm của virus (Munoz và Carrasco, 1981).
Với IFN- γ, việc sản xuất nội sinh trong vật nuôi phần lớn bị giới hạn ở các tế bào của hệ thống miễn dịch (tế bào NK, tế bào lymphocyte). Tuy nhiên, các thụ thể của IFN- γ (IFNGR1/2) được biểu hiện rộng rãi và do đó, hầu như tất cả các loại tế bào đều có khả năng đáp ứng với IFN- γ (Valente và cộng sự, 1992). Không giống như IFN-α, sau khi liên kết với thụ thể của nó, IFN-γ kích hoạt JAK, gây ra sự phosphoryl hóa STAT1 và hình thành các homodimer. Sau đó, dimer đi vào nhân và kích hoạt các yếu tố GAS (chuỗi được kích hoạt bằng gamma) để gây ra sự biểu hiện của ISG (O’Shea và cộng sự, 2015). Các tác nhân gây bệnh như PRRS và ASFV xâm nhập và lây nhiễm và các tế bào bạch cầu như đại thực bào và tế bào tua, IFN-γ hoạt hóa đại thực bào và giúp chúng có khả năng đáp ứng miễn dịch hiệu quả hơn, như tăng cường xử lý và trình diện kháng nguyên thông qua việc điều hòa tăng cường MHC lớp II, tăng sản xuất ROS và NOS nhằm kích thích quá trình tự thực bào để loại bỏ các tác nhân gây bệnh nội bào và tăng tiết các cytokine tiền viêm. Ngoài ra, nó có thể hoạt hóa và tăng hoạt tính của tế bào NK và cũng điều hòa sản xuất kháng thể để điều chỉnh đáp ứng tế bào B. IFN-γ cũng thúc đẩy tăng trưởng và trưởng thành của các loại tế bào khác và sự di chuyển của bạch cầu. IFN-γ cũng điều hòa sản xuất protein quan trọng, cụ thể là tethrin hoặc viperin, tham gia vào việc hạn chế và can thiệp vào quá trình thoát virion ra khỏi tế bào hoặc lắp ráp virus. Tethrin hoạt động như một yếu tố hạn chế chống lại các loại virus bằng cách ngăn chặn virus thoát ra khỏi đại thực bào bị nhiễm bệnh (bài 4). IFN-γ đã nổi lên như một cytokine cực kỳ linh hoạt, có thể thực hiện vô số hoạt động sinh học không trùng lặp với các interferon khác. Bất kỳ sự suy yếu nào trong hệ thống IFN-γ-IFN-γR đều cản trở nghiêm trọng phản ứng miễn dịch của vật chủ đối với nhiễm trùng. Do đó, tầm quan trọng của nó trong việc tạo ra khả năng miễn dịch bảo vệ trong các bệnh truyền nhiễm là rất quan trọng.
Sử dụng Interferon alpha và Interferon gamma như là mục tiêu và công cụ của chiến lược điều chỉnh miễn dịch kiểm soát PRRS và ASF

Hiện tại, các nghiên cứu bao gồm cả in vitro và in vivo vẫn còn đang tiếp tục được triển khai để làm rõ thêm các con đường điều hòa của IFN và phát triển chiến lược phòng chống bệnh hiệu quả cho ASF và PRRS. Tuy nhiên, đã có nhiều bằng chứng cho thấy hiệu quả của IFN-α và IFN-γ nhằm kiểm soát hai tác nhân gây bệnh này.
PRRSV đã được chứng minh là nhạy cảm với IFN-α cả trong ống nghiệm và trong cơ thể sống (Elisabetta và công sự, 2021). Đặc biệt, IFN-α heo tái tổ hợp có thể ức chế sự phát triển của vi-rút trong đại thực bào phế nang lợn (PAM). IFN-γ ảnh hưởng rõ rệt đến sự nhân lên của PRRS trong đại thực bào lợn về mặt giảm nồng độ và tỷ lệ tế bào dương tính, tác dụng này phụ thuộc vào liều lượng và liên quan đến thời gian tiếp xúc.
Điều trị bằng IFN-α liều thấp bằng đường uống trong các đợt bùng phát PRRS đã chứng tỏ hiệu quả lâm sàng tại các trang trại ở cả heo nái và heo con. Những kết quả này phù hợp với cơ chế tác dụng mạnh của IFN-α liều thấp được thể hiện trong mô hình tế bào amidan heo trong ống nghiệm (Saalmuller và cộng sự, 1994). Ttrong đó nhấn mạnh các mô lympho miệng là mục tiêu quan trọng của phương pháp điều trị cytokine liều thấp bằng đường uống này. Adomi và cộng sự (2007) đã tiến hành hai thử nghiệm thực địa về phương pháp điều trị bằng IFN- α liều thấp của người dạng uống (10 IU/kg thể trọng/ngày) trên các đàn có vấn đề, bị ảnh hưởng bởi các đợt bùng phát PRRS tái phát. Thử nghiệm đầu tiên được tiến hành trên một đàn lớn, đa địa điểm, từ khi đẻ đến cai sữa, bị ảnh hưởng bởi một dạng PRRS hô hấp điển hình, nghiêm trọng về mặt lâm sàng. Kết quả cho thấy phương pháp điều trị bằng IFN- α liều thấp dạng uống đã làm giảm đáng kể số lợn con chết và "lợn con kém" (P < 0,01). Đồng thời, phương pháp điều trị cũng cho kết quả tăng trọng lượng trung bình hàng ngày (ADWG) lớn hơn nhiều từ 22 đến 86 ngày tuổi (0,48kg/ngày ở nghiệm thức thí nghiệm so với 0,44kg/ngày ở nhóm đối chứng). Nhóm tác giả này cũng thử nghiệm phương pháp điều trị này tại hai trang trại bị ảnh hưởng nặng nề bởi PRRS sinh sản, phương pháp điều trị được áp dụng cho tất cả nái mang thai bất kể giai đoạn mang thai. Trong cả hai trường hợp trên nái nuôi trong chuồng đẻ và thử nghiệm trên bất kỳ giai đoạn nào, đều cho thấy việc giảm đáng kể cả tỷ lệ sảy thai ở nái và tỷ lệ tử vong ở heo con bú mẹ trong vòng 2 tuần sau khi sử dụng IFN-α .
Một số nghiên cứu đã quan sát thấy cả chủng ASFV giảm độc lực và độc lực đều nhạy cảm với Interferon-α1 bò và IFN-γ heo ở cả tế bào đơn nhân lợn và đại thực bào phế nang heo (PAM), trong đó hoạt tính kháng vi-rút hiệu quả nhất được phát huy ở PAM được xử lý bằng IFN-γ (Esparza và cộng sự, 1988). Kết quả tương tự cũng thu được ở tế bào Vero được xử lý trước bằng IFN-α người và sau đó được nhiễm BA71V giảm độc lực (Paez và cộng sự, 1990). Nghiên cứu được thực hiện trong ống nghiệm cho thấy, trong số các ISG, hai protein xuyên màng do Interferon gây ra (IFTM2 và IFITM3) làm giảm khả năng lây nhiễm của chủng độc lực ASFV BA71V trong tế bào Vero, bằng cách làm suy yếu quá trình xâm nhập và giải phóng virus qua trung gian nội bào, trong khi protein MxA ức chế BA71V trong tế bào Vero (Muñoz-Moreno và cộng sự, 2016).
Nghiên cứu của Fan và cộng sự (2020), sử dụng Interferon heo PoIFN-α và PoIFN-γ tái tổ hợp được kết hợp như một phương pháp điều trị khẩn cấp cho heo dương tính với ASFV. Các đại thực bào phế nang sơ cấp được xử lý bằng PoIFN-α và PoIFN-γ tái tổ hợp được thu thập để phân lập các tế bào lympho ngoại vi, các ISG, biểu hiện phân tử MHC và đầu ra của virus. Biểu hiện gen do Interferon gây ra và các phản ứng miễn dịch đã được định lượng và so sánh với những phản ứng sau khi gây nhiễm virus ASF trên heo giữa nghiệm thức xử lý Interferon PoIFN-α và PoIFN-γ tái tổ hợp và đối chứng. Kết quả cho thấy PoIFN-α và PoIFN-γ tái tổ hợp có vai trò chống virus hiệu quả hơn. Các gen được kích thích bởi IFN có các cơ chế khác nhau để ức chế sự nhân lên của virus, như liên kết và điều hòa chức năng của protein tế bào và virus và RNA hoặc DNA. Kết quả nghiên cứu còn cho thấy sự kết hợp của Interferon heo PoIFN-α và PoIFN-γ heo tái tổ hợp có hoạt tính kháng virus cao đối với ASFV ở tế bào đại thực bào phế nang phổi của lợn (PAM). Hơn nữa, kết quả nghiên cứu cũng cho thấy là kết hợp PoIFN-α và PoIFN-γ tái tổ hợp liều thấp kết hợp (105 U/kg) có thể điều hòa đáng kể lượng cytokine, giảm đáng kể lượng virus đầu ra, ức chế sự phát triển của ASFV và làm giảm các dấu hiệu lâm sàng của nhiễm trùng sớm.
Chế phẩm UV-GLUCANRON.S1- Sự kết hợp của Intereron PoIFN-α và PoIFN-γ tái tổ hợp biểu hiện từ tế bào Pichia pastoris: Liệu pháp từ nguyên lý đến thực tế sản phẩm phòng trị bệnh.

Theo nhiều tài liệu nghiên cứu, ASF và PRRS là những bệnh mà có khả năng phát triển nhiều chiến lược trốn tránh và điều chỉnh phản ứng miễn dịch bẩm sinh của vật chủ.
Với PRRS, điều này phần lớn có thể liên quan đến tác động của protein vi-rút lên các điểm kiểm soát quan trọng của phản ứng miễn dịch bẩm sinh, bao gồm các nhánh khác nhau của hệ thống IFN. Đặc biệt, ít nhất ba protein phi cấu trúc (Nsp1, Nsp2 và Nsp11) và protein nucleocapsid. Nó đóng vai trò quan trọng trong việc ức chế các con đường IFN và NF-κB (Yoo và cộng sự, 2010). Do đó, nhiễm trùng PRRSV thường dẫn đến miễn dịch bẩm sinh và thích ứng không kịp thời, không hiệu quả, bao gồm cả việc kích hoạt kém các phản ứng miễn dịch qua trung gian tế bào. Vì vậy, việc tạo các phản ứng miễn dịch bẩm sinh kịp thời và hiệu quả có lẽ có tầm quan trọng lớn đối với việc kiểm soát nhiễm trùng PRRS.
Với ASF, nhiều tài liệu đã cho thấy các chủng độc lực của virus ASF dường như đã phát triển các cơ chế để ức chế sự cảm ứng IFN loại I; ngược lại, các chủng giảm độc lực có thể đã mất một phần các cơ chế trốn tránh miễn dịch này. Correia và cộng sự (2013) đã chứng minh rằng các họ đa gen (MGF) được mã hóa bởi ASFV ức chế phản ứng IFN loại I và II bằng cách nhắm mục tiêu vào các chất trung gian truyền tín hiệu nội bào khác nhau. Gần đây nhất, Reis và cộng sự (2016) đã báo cáo rằng việc xóa và ngắt một số gen trong vùng MGF360 và MGF530/505 ở chủng Benin 97/1 độc lực đã dẫn đến việc tạo ra mức mRNA IFN-β cao trong ống nghiệm, so với chủng Benin 97/1 độc lực tự nhiên. Điều này đã được xác nhận bởi một nghiên cứu đã đề cập trước đó, theo đó các chủng độc lực đã phát triển nhiều chiến lược để trốn tránh và điều chỉnh hệ thống miễn dịch bẩm sinh bằng cách hạn chế hoặc làm suy yếu phản ứng IFN loại I và II.
Vì những lý do đó, việc bổ sung Inteferon PoIFN-α và PoIFN-γ tái tổ hợp là một giải pháp hữu hiệu để hỗ trợ hệ thống miễn dịch bẩm sinh nhằm phòng ngừa các tác động bất lợi cũng như quá trình xâm nhiễm của ASFV và PRRS. Việc biểu hiện từ tế bào P. Pastoris, với bản chất là một eukaryote, nên có thể cung cấp môi trường thích hợp cho PoIFN-α và PoIFN-γ tiết ra, cũng như thực hiện các biến đổi sau dịch mã (gấp cuộn, hình thành cấu nối disulfide, và glycosyl hóa), tạo tính tương đồng với cấu trúc nterferon nội sinh và đã được chứng minh trong nhiều tài liệu nghiên cứu với hoạt tính sinh học cao (Macauley-Patrick và công sự, 2005; Jin và cộng sự 2010, 2011; He và cộng sự, 2018; Cai và cộng sự, 2019).
|
|
|
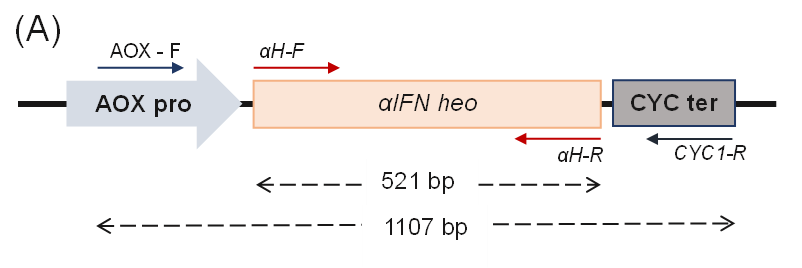
Hình 2a. Kết quả tạo dòng PinkPichia IFN-α heo
- Sơ đồ bắt cặp mồi trên genome PinkPichia
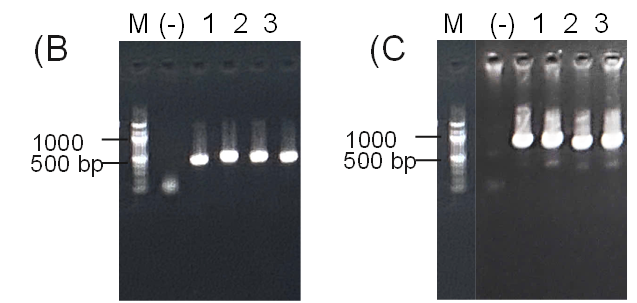
- Sản phẩm khuếch đại của phản ứng PCR khuẩn lạc với cặp mồi đặc hiệu αH-F/R. M: thang 100 bp; Giếng 1: chứng âm-khuôn mẫu được thay bằng nước cất; Giếng 1-4: genome của các thể biến nạp PinkPichia IFN-α heo
- Sản phẩm khuếch đại của phản ứng PCR khuẩn lạc với cặp mồi đặc hiệu AOX-F/R. M: thang 100 bp; Giếng 1: chứng âm-khuôn mẫu được thay bằng nước cất; Giếng 1-4: genome của các thể biến nạp PinkPichia IFN-α heo
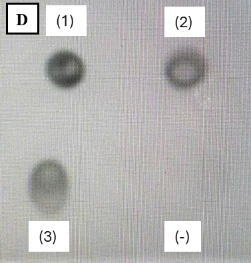
- Kết quả doblot kiểm tra protein IFN-α heo tái tổ hợp với kháng thể đặc hiệu anti-IFN-α heo: (-) dịch nuôi cấy PinkPichia IFN-α heo trước cảm ứng, (1) (2) (3) dịch nuôi cấy PinkPichia IFN-α heo sau cảm ứng
|
|
|
|
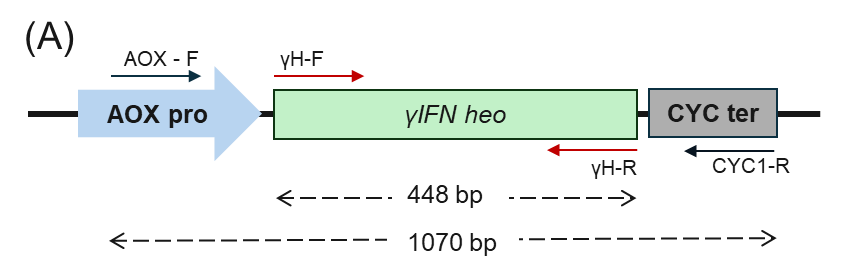
Hình 2b. Kết quả tạo dòng PinkPichia IFN-γ heo
- Sơ đồ bắt cặp mồi trên genome PinkPichia
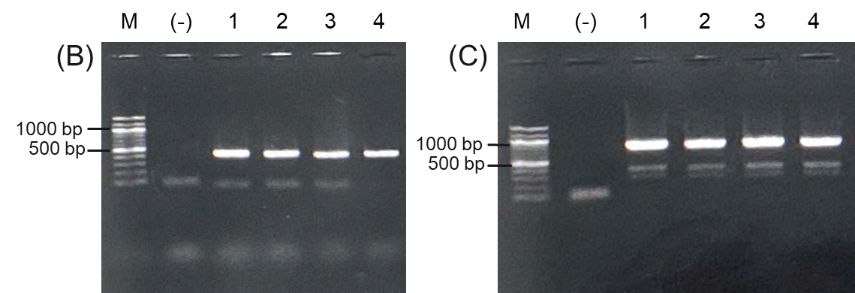
- Sản phẩm khuếch đại của phản ứng PCR khuẩn lạc với cặp mồi đặc hiệu γH-F/R. M: thang 100 bp; Giếng 1: chứng âm-khuôn mẫu được thay bằng nước cất; Giếng 1-4: genome của các thể biến nạp PinkPichia IFN-γ heo
- Sản phẩm khuếch đại của phản ứng PCR khuẩn lạc với cặp mồi đặc hiệu AOX-F/R. M: thang 100 bp; Giếng 1: chứng âm-khuôn mẫu được thay bằng nước cất; Giếng 1-4: genome của các thể biến nạp PinkPichia IFN-γ heo
- Kết quả doblot kiểm tra protein IFN-γ heo tái tổ hợp với kháng thể đặc hiệu anti- IFN-γ heo: (-) dịch nuôi cấy PinkPichia IFN-γ heo heo trước cảm ứng, (1) (2) (3) dịch nuôi cấy PinkPichia IFN-γ heo sau cảm ứng
Chế phẩm UV-GLUCANRON.S1 bao gồm kết hợp của Intereron PoIFN-α và PoIFN-γ tái tổ hợp từ tế bào Pichia pastoris, được sử dụng theo đường miệng bằng cách cho ăn hoặc cho uống. Theo con đường này, bên cạnh sự tiện lợi, PoIFN-α và PoIFN-γ tái tổ hợp bổ sung sẽ được liên kết với các thụ thể IFN trên khắp đường tiêu hóa có thể tạo ra sự truyền tín hiệu đến các mô bạch huyết bên dưới. Kết quả chung là tạo tình trạng miễn dịch của động vật bị thay đổi, điều này gây ra sự khó khăn cho sự nhân lên của virus. Nhìn chung, mức độ lưu giữ nhận thấy cao hơn trong một số mô gần với các mô bạch huyết chính. Gần lưỡi sau, có một mô bạch huyết được gọi là vòng Waldeyer. Sự lưu giữ IFN rõ ràng được nhìn thấy ở lưỡi sau có thể đại diện cho việc IFN liên kết với bạch cầu trong biểu mô hoặc tế bào đuôi gai nằm trong niêm mạc (vòng Waldeyer). Mẫu mô khoang mũi sau cũng chứa một mô bạch huyết, mô bạch huyết liên quan đến mũi (NALT). Sự ổn định của của INF- α với axit đến pH 2,0, cùng với dạng bào chế dựa trên các polymer bảo vệ giúp các PoIFN-α và PoIFN-γ tái tổ hợp duy trì cấu trúc và độ ổn định về mặt cấu hình, từ đó duy trì và ổn định hoạt tính sinh học của chúng. Hơn nữa, các chất mang polymer này còn giúp bảo vệ chúng khỏi sự phân hủy hóa học và enzyme. Từ đó cho phép PoIFN-α và PoIFN-γ dùng đường uống duy trì hoạt tính sinh học sau khi đi qua môi trường axit của dạ dày để tiếp xúc với tế bào lympho trong biểu mô hoặc tế bào đuôi gai (hoặc cả hai) hiện diện ở phần gần ruột non đến các mô bạch huyết cục bộ, các màng nhầy dịch vị đặt trung của ruột (The Peyer’s patches). Trực tràng có các nốt bạch huyết nằm rải rác khắp bề mặt niêm mạc của nó, cũng là vị trí đặc hiệu của liên kết thụ thể IFN và được lưu giữ lại.
Tóm lại, kiểm soát tốt mô hình an toàn sinh học mới cùng với sự kết hợp chặt chẽ giữa giám sát lâm sang, thực hành chăn nuôi tốt, kiểm soát môi trường chăn nuôi và miễn dịch dự phòng là rất cấn thiết để kiểm soát hiệu quả ASF và PRRS. Trong bối cảnh diễn biễn bệnh phức tạp, không chỉ PRRS và ASF, mà còn là sự xuất hiện nhiều bệnh mới trên heo, các chế phẩm điều hòa miễn dịch như UV-GLUCANRON.S1 là công cụ hữu ích để giúp phòng ngừa và kiểm soát các tác nhân gây bệnh nguy hiểm đang tái phát như PRRS và ASF.
Nguồn: Bài viết thuộc bản quyền của UV-Việt Nam. Khi chia sẻ, vui lòng ghi rõ nguồn.

 Facebook
Facebook  Youtube
Youtube